Equilibrio Químico |
||||
|
|
Concepto
de equilibrio químico
Ahora vamos a tratar de definir el concepto de equilibrio químico partiendo de las ideas del artículo anterior y de conceptos nuevos como el de reacción directa y el de reacción inversa. Voy a volver a considerar la misma reacción química: H2
+ I2
® 2HI Aunque todavía no definimos el concepto de equilibrio químico, decimos que cuando tenemos una reacción que alcanza un equilibrio químico (que no alcanza a completarse al 100%), existen dos reacciones en la reacción general, una directa y una inversa. Por comodidad
generalmente la reacción directa se considera la que consideramos
objeto de estudio o la que nos interesa analizar. En nuestro caso la reacción que nos interesa en la
que lleve a la formación del HI, es decir, la reacción directa para
nosotros será H2 + I2
® 2HI en donde nuestros reactivos
son el Yodo y el hidrógeno y el producto el HI. Pero también existe
la reacción en la que se descompone el HI para formar I2
y H2 , H2 + I2 ¬ 2HI, en esta reacción el reactivo
es el HI y los productos son el H2 y el I2. Por
esta razón la reacción global se escribe con dos flechas opuestas para
indicar la existencia de dos reacciones una directa y una inversa y
por su puesto para indicar que
se trata de una reacción que alcanza un equilibrio químico. Tal vez sea un poco inusual decir que en una
reacción química que estoy estudiando, sean realmente dos una directa y una
inversa, pero se emplea de esta manera generalmente. Por otro lado, es importante
mencionar que una de las
características de este tipo de reacción químicas es que se llevan acabo al
mismo tiempo la reacción directa y la inversa; es decir, cuando llevo acabo
la reacción para formar el HI, también se lleva acabo la reacción en la que
se descompone el HI. |
|||
Un concepto que
ya tocamos anteriormente y que usamos pero sin definirlo es el concepto de “Velocidad de Reacción”. En términos muy
generales velocidad de reacción es la cantidad de una sustancia que se produce
o se descompone por unidad de tiempo (s, min, h, día, ...) en una reacción
química.
¿Cómo
varía la velocidad de reacción en una
reacción química de este tipo?
Como ya sabemos, en realidad en este tipo de
reacciones hay dos: una directa y una inversa.
En nuestro caso la velocidad de reacción de la
reacción directa es rápida, es decir al inicio de la reacción la producción de
HI por unidad de tiempo, es elevada; es decir, se produce una elevada cantidad
de HI. Pero al transcurrir el tiempo va disminuyendo la producción de HI por
unidad de tiempo.
En caso contrario, la velocidad de reacción de la
reacción inversa es lenta; se descompone un pequeña cantidad de HI por unidad
de tiempo y aquí conforme transcurre el tiempo la velocidad va aumentando.
En conclusión: en una reacción química
en la que estén involucradas dos reacciones químicas(directa e inversa) la
velocidad de alguna de las dos al inicio de la reacción es elevada y disminuye
y la de la otra es lenta y va aumentando.
Vamos a tratar de explicarlo considerando nuestra
reacción; cuando pongo en contacto el H2 y el I2 la
velocidad con la que comienzan a interactuar para formar el HI es muy alta y
conforme va transcurriendo el tiempo esta va disminuyendo; en otras palabras al
inicio se produce una elevada cantidad de IH, por ejemplo 3.2 g de HI por
segundo pero al los 50 segundos de iniciada la reacción solo se producen 0.5 g
de HI por segundo “la velocidad de producción por segundo de HI disminuye”.
Pero además aquí ocurre un fenómeno muy interesante, en el momento en que se
empieza a producirse el HI durante la reacción una parte de esta sustancia (HI)
se empieza a descomponer en H2 y I2 (reacción inversa)
con una velocidad lenta, lo contrario
de la anterior, y conforme avanza el tiempo esta va aumentando. Veamos el
siguiente esquema:
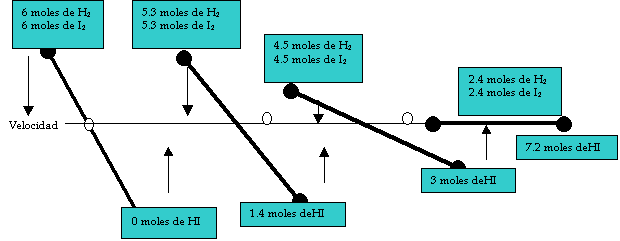
Tiempo
![]()
El esquema trata de explicar que en un inicio la
velocidad con la que interactúan el H2 y el I2 es alta
para producir el HI; y en el mismo momento en que se empieza a producir el HI,
un cantidad pequeña de este se empieza a descomponer en H2 y en I2
pero con una velocidad lenta, todo ello
ocurre al inicio de la reacción. Sin embargo, conforme transcurre el
tiempo la velocidad de la reacción
directa disminuye y la velocidad de la reacción inversa aumenta hasta, como se
observa en el esquema se igualan.
Por ejemplo, en el momento que se igualan las
velocidades de reacción la cantidad de HI que se produce es igual a la cantidad
de HI que se descompone por unidad de tiempo o la cantidad de H2 y I2
que reaccionan para producir el HI es
la misma cantidad que se produce de la descomposición del HI .
¡PARA ENTENDER MEJOR! '
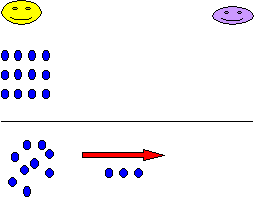
Es como un juego de dos niños A (amarillo) y M
(morado), en donde A tiene 12 pelotas azules y se las va a dar a M. Al inicio
en el primer intento le comienza a mandar a “A” 3 pelotas a “M”, quedando A con 9 y M con 3. En un segundo
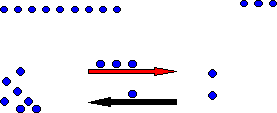
intento “A” vuelve a enviar tres pelotas a “M”, pero ahora “M” manda una pelota
a A de las tres que le enviaron en el primer intento; quedando A con 7 (9-3+1),
y M con 5(3-1+3). En el tercer intento “A” envía ahora solo 2 pelotas a “M”
(una pelota menos que en los intentos anteriores), y además, “M” también envía
dos pelotas a “A” (una más que en el anterior intento), quedando “A” con 7
(7-2+2) pelotas y “M” con 5(5-2+2)
pelotas. Finalmente, varios intentos en los que “A” envía 2 pelotas a “M”, y
“M” envía dos pelotas a “A”; quedando nuevamente A con 7 y M con 5.
Aquí, ocurre un fenómeno interesante parece que los niños en los últimos intentos se quedaron con el mismo numero de pelotas. Si tuviéramos un niño G, que no viera el momento en el que los niños A y M hacen el intercambio, y únicamente contara el número de pelotas con las que se quedaron los niños A y M, supondrá que no hubo intercambio, pero sí lo hay.
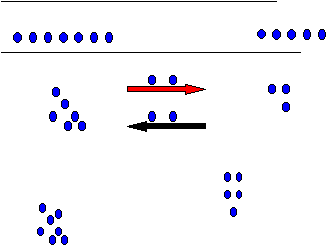
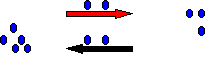

Este ejemplo muestra, a manera de analogía lo que ocurre con una reacción química cuando alcanza el equilibrio químico. Como vemos con el intercambio de pelotas en los últimos intentos los intercambios son iguales y al mismos tiempo; lo que ocurre justamente con la reacción química cuando alcanza el equilibrio químico. Ahora bien vamos a definir los que es equilibrio químico y posteriormente deduciremos la ecuación que la representa.
EQUILIBRIO QUÍMICO: Es un estado
dinámico, en donde 2 reacciones opuestas entre sí se verifican simultáneamente
a la misma velocidad en la unidad de tiempo.
VELOCIDAD DE REACIÓN: Es la
transformación química de sustancias en la unidad de tiempo.
LEY DE ACCIÓN DE MASAS: La velocidad con la que se efectúa una
reacción química es directamente proporcional al producto de las concentraciones
de las especies interaccionantes, elevada cada una de ellas a un exponente tal que corresponda al
coeficiente estequiométrico en la ecuación química balaceada.
DEDUCCIÓN DE LA CONSTANTE DE QUILIBRIO QUÍMICO
Cuando
una reacción alcanza el equilibrio químico, este es caracterizado por una constante, llamada constante de
equilibrio químico “Ke”,la cual se deduce de la siguiente manera:
Consideremos la siguiente ecuación química general,
aA +
bB ® cC + dD
en donde,
A, B, C y D son las sustancias involucradas en la
reacción.
a, b, c, y d
son los coeficientes estequiométricos.
Considerando el concepto de Ley de Acción de Masas y
tomando en cuenta que en la reacción anterior están involucradas dos reacciones
una directa y una inversa tenemos:
a) la velocidad de reacción de la reacción
directa es proporcional a las
concentraciones de las especies A y B elevadas a su coeficiente estequiometrico
a y b.
Vd
µ [A]a[B]b ................(1)
b) la velocidad de reacción de la reacción inversa
es proporcional a las concentraciones de las especies C y D elevadas a su
coeficiente estequiometrico c y d.
Vi µ [C]c[D]d
.................(2)
Para poder igualar (1) y también (2), es decir,
quitar el símbolo de proporcionalidad (µ) es necesario introducir
una constante de proporcionalidad:
Vd = Kd[A]a[B]b y Vi = Ki[C]c[D]d
Ya sabemos que en el equilibrio las velocidades son
iguales tanto la de la reacción directa como la de la reacción inversa, por lo
tanto,
En el equilibrio: Vd
= Vi , por lo tanto,
Kd[A]a[B]b = Ki[C]c[D]d ……………(3)
Ordenando
(3), finalmente tenemos,
|
Ke =
|
Ki
|
=
|
[C]c[D]d
|
|
Kd
|
[A]a[B]b
|
||
Observaciones:
§
Las
concentraciones que figuran en la ecuación no son concentraciones iniciales,
sino las concentraciones que se alcanzan en el equilibrio.
§
El
valor de la constante de equilibrio Ke, esta en función de la temperatura, es
decir, a diferentes temperaturas tiene diferentes valores.
§
Como
concentración [ ] se expresa a una sustancia disuelta; sí en una ecuación
alguna sustancia aparece en estado sólido, su cantidad se considerara igual a
la unidad (1).
§
Si
en la reacción química intervienen sustancias en estado gaseoso, se expresara
no su concentración sino su presión parcial.
| Principio de Lê-Chatelier |
